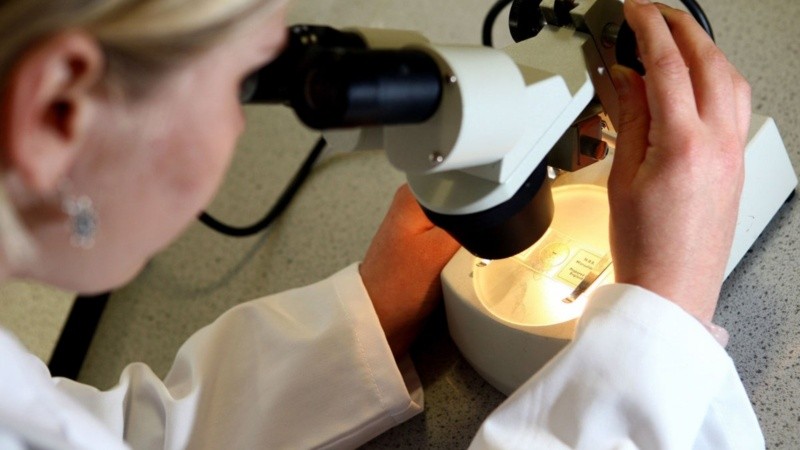
La Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) del Reino Unido autorizó la primera terapia genética del mundo para tratar la anemia falciforme y la beta-talasemia dependiente de transfusiones.
El tratamiento, conocido como exagamglogene autotemcel pero comercializado como Casgevy, es el primer medicamento autorizado que se basa en la tecnología de edición de genes CRISPR, reconocida con el Premio Nobel en 2020.
Casgevy
Se trata del primer medicamento autorizado para mayores de 12 años, el cual se enfoca en corregir los errores genéticos en los genes de la hemoglobina, responsables de la anemia de células falciformes y la beta-talasemia.
Estas afecciones genéticas, comunes en personas con antecedentes africanos, caribeños, mediterráneos, del sur y sudeste asiático y de Oriente Medio, pueden causar dolor intenso, infecciones graves y anemia.
El procedimiento implica la extracción, edición y reinfusión de células madre de la médula ósea del paciente, con el potencial de producir hemoglobina funcional de por vida.
"Tanto la anemia de células falciformes como la beta-talasemia son afecciones dolorosas y potencialmente fatales. Estamos complacidos de autorizar Casgevy, un tratamiento innovador que demostró restaurar la producción de hemoglobina saludable y aliviar síntomas en la mayoría de los participantes de los ensayos", dijo en un comunicado Julian Beach, director ejecutivo interino de calidad y acceso a la atención médica de la MHRA.
John James, director ejecutivo de la Sociedad de células falciformes, agregó por su parte que "la anemia falciforme es una afección debilitante y potencialmente mortal". Y afirmó: "Este nuevo tratamiento es una noticia bienvenida para mejorar la calidad de vida de muchos pacientes".
En el ensayo para la anemia de células falciformes, el 97% de los pacientes no experimentó crisis de dolor tras recibir Casgevy. Mientras que, en el ensayo para la beta-talasemia, el 93% evitó transfusiones de glóbulos rojos durante al menos 12 meses después del tratamiento. Por su parte, los efectos secundarios fueron similares a los de los trasplantes de células madre autólogas.
Casgevy se administra extrayendo y editando células madre, seguido de un tratamiento de acondicionamiento antes de reinfundirlas en el paciente, que puede requerir hospitalización por al menos un mes.
Fuente: Télam.