A finales de la semana pasada se popularizó una noticia en loos medios de comunicación: la Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas inglés) aprobó un nuevo tratamiento que los titulares llamaron “el nuevo viagra femenino”. La venta del Vyleesi, como lo bautizó la compañía que lo produce, fue autorizada para una indicación más precisa: el trastorno del deseo sexual hipoactivo generalizado adquirido o HSDD, como es conocido en el mundo médico.
Tal como publica elespectador, el anuncio de la FDA venía acompañado de una explicación de Hylton V. Joffe, director del centro de evaluación de medicamentos e investigación del área de productos reproductivos y urológicos. “Hay mujeres que, sin ninguna razón conocida, tienen un deseo sexual reducido que les genera angustia y pueden beneficiarse de un tratamiento farmacológico seguro y eficaz. La aprobación de hoy brinda a las mujeres otra opción de tratamiento para esta afección. Continuaremos apoyando el desarrollo de tratamientos seguros y efectivos para la disfunción sexual femenina”.
Pero como lo dice la página de la FDA, el Vyleesi, que mejora el deseo sexual mas no el rendimiento sexual, puede tener serias complicaciones si lo usan mujeres con enfermedades cardiovasculares. Es un grupo poblacional que puede estar en alto riesgo, debido a que el medicamento aumenta la presión arterial.
Quienes consuman Vyleesi es posible que también tengan náuseas, vómito y dolores de cabeza. “El 40 % de las personas que participaron en el ensayo clínico experimentaron náuseas y el 13 % necesitó medicamentos para el tratamiento de esas náuseas”, se lee en la publicación de la FDA.
Además, dice en otro apartado, el 1 % de las pacientes aseguraron que, tras consumir el fármaco, presentaron oscurecimiento en sus encías y algunas partes de la piel, entre las que estaban los senos y la cara. Las mujeres que tenían piel oscura eran las más propensas a desarrollar ese efecto.
“Aconseje a los pacientes que suspendan el Vyleesi si hay sospecha de un embarazo”, reitera AMAG Pharmaceuticals en su página web. Allí mismo recomienda no tomarlo en caso de que esté en un tratamiento con naltrexona, un popular medicamento para tratar la adicción de opiáceos, un serio problema de salud pública que Estados Unidos no ha podido contener.
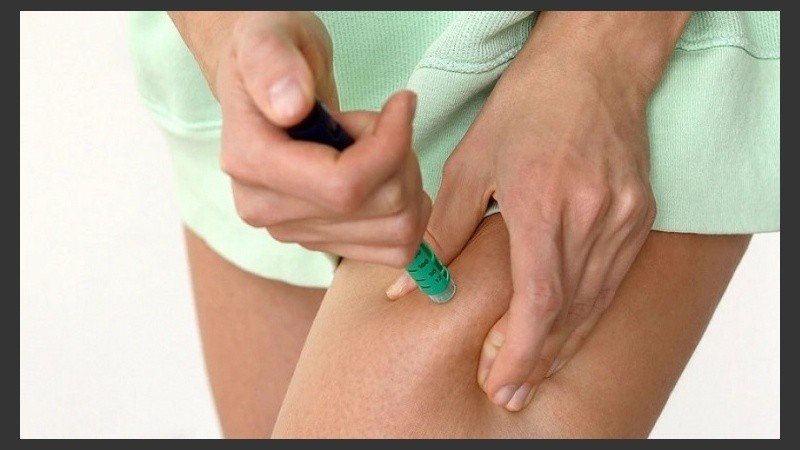
Otro riesgo más que deben enfrentar quienes consuman Vyleesi es uno obvio: como debe inyectarse en el abdomen o en el muslo 45 minutos antes de tener sexo, puede haber enrojecimiento en el lugar del pinchazo.
Fuente: elespectador.com