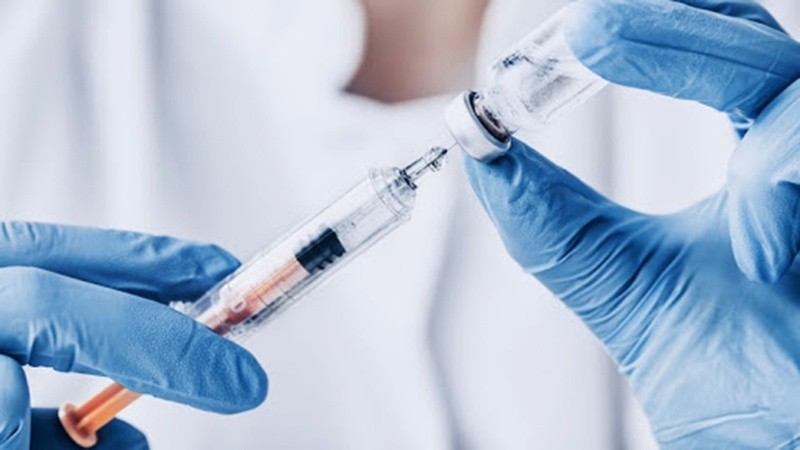
La Fundación Huésped anunció el inicio de un nuevo estudio de Fase 3 de una vacuna desarrollada por el Beijing Institute of Biotechnology, CanSino Biologics Inc, de China, contra el SARS-CoV-2 que será llevado adelante en 11 centros de salud en el Área Metropolitana de Buenos Aires (AMBA) y Mar del Plata.
Según afirmó el comunicado de la Fundación “no es posible que una persona pueda infectarse de covid-19 por la vacuna de este estudio” porque "utiliza un enfoque de vector viral que toma un virus vinculado al resfrío común (adenovirus) al que se le agrega genéticamente una proteína propia del covid-19 para poder ser reconocido por el sistema inmunológico y, así, generar inmunidad”. Es decir que “no incluye al virus real del SARS-CoV-2”.
El infectólogo y director científico de la Fundación Huésped, Pedro Cahn, aseguró este lunes, en diálogo con Télam, que la vacuna de CanSino Bio “es un sistema similar a la de AstraZeneca, a la de Gameleya (Sputnik V) y la vacuna de Janssen que también están montadas sobre adenovirus”.
“Por el momento es una perspectiva en Argentina muy auspiciosa por los resultados. Hay cuatro vacunas que ya han mostrado resultados a corto plazo y no puede ser casualidad que las cuatro hayan dado arriba del 90%”, consideró.
Sobre los centros de reclutamiento, explicó que se realizó “una selección de centro basados en su capacidad de reclutamiento y en su experiencia clínica”.
“El primer centro que se va a abrir es acá en la Ciudad de Buenos Aires esta semana donde se van a incorporar pacientes a partir del jueves”, explicó y agregó que en Argentina serán reclutadas 8.000 personas.
Aclaró que “progresivamente que se van dando las autorizaciones de los comité de ética de los centros y de esa manera se van a ir incorporando hasta llegar a los 11”.
El documento informó que “en los estudios de Fase 1 y 2 de esta vacuna participaron 616 personas voluntarias que fueron vacunadas con buenos resultados preliminares y sin efectos adversos serios” y añadió que en simultáneo con el estudio que coordina en Argentina Fundación Huésped, el estudio multicéntrico internacional se está llevando a cabo en Chile, México, Rusia y Arabia Saudita.
En tanto, se detalló que el desarrollo de CanSino Bio contempla una vacuna de una sola dosis, que se conserva a entre 2 y 8 grados, lo que “facilita la logística en caso de mostrar buenos resultados en el estudio de Fase 3”.
Respecto al estudio, que durará un año e incluirá 40.000 voluntarios en todo el mundo, la organización indicó que es aleatorizado, es decir, recibir la vacuna o el placebo dependerá del azar; de doble enmascaramiento lo que significa que ni la persona voluntaria ni el equipo investigador saben si recibió la vacuna o el placebo.
Además, está controlado con placebo -una sustancia inerte-, en grupos paralelos para evaluar la inmunogenicidad (la capacidad de activar el sistema inmune) y la seguridad de una vacuna con vector viral.
“Al igual que la Janssen, esta vacuna está diseñada inicialmente con una sola dosis, lo cual no quiere decir que no se pueda hacer con dos. Está previsto en el protocolo lo que se llama un diseño adaptativo de acuerdo al tipo de respuesta que se va encontrando”, aclaró Cahn.
El diseño de una dosis “responde al hecho que se vio que en la fase dos tenía muy buena respuesta inmune. Sería muy bueno que todas las vacunas pudieran ser de una sola dosis porque con la misma cantidad de vacunas podemos vacunar a más gente”, señaló el infectólogo.
“Desde el punto de vista logístico es más sencillo porque lo que pasa con las vacunas que requieren dos dosis hay gente que no vuelve para aplicarse la segunda. Lo mejor sería una sola dosis si los resultados así lo indican”, explicó.
Acerca del tiempo de inmunidad que brinda la vacuna afirmó que no se sabe para esta “ni para ninguna otra porque no tenemos tiempo suficiente de observación”.
Podrán participar del estudio personas mayores de 18 años, que por su historia clínica y examen físico tengan un buen estado de salud, la participación es voluntaria y no remunerada.
Una vez que las personas voluntarias hayan dado su consentimiento por escrito, el equipo investigador a cargo indagará sobre antecedentes médicos y se realizarán análisis clínicos, y en la misma visita se aplicará la dosis de vacuna o placebo.
La persona voluntaria deberá permanecer, luego de la aplicación de la dosis, 30 minutos en observación.
Asimismo, será contactada frecuentemente por teléfono para verificar su estado de salud y deberá reportar síntomas en una App en su teléfono celular aproximadamente, un año después de haber recibido la dosis de vacuna o placebo.
En tanto, se aclara que, a la fecha, los efectos adversos registrados se limitan a "dolor en el sitio de inyección y/o fiebre, ambos de magnitud leve y autolimitados. No se han reportado eventos adversos serios", explicaron.
Quienes quieran postularse pueden hacerlo ingresando a https://estudios.huesped.org.ar/.
Más información