Cada vez existen más formas de producir células T con CAR en el cuerpo, lo que genera esperanzas de que las terapias contra el cáncer notoriamente caras y personalizadas algún día puedan volverse más accesibles. En este aspecto, se están ideando formas de editar los genomas de las células inmunitarias sin tener que extraerlas de las que están siendo tratadas.
Tratamiento CAR-T
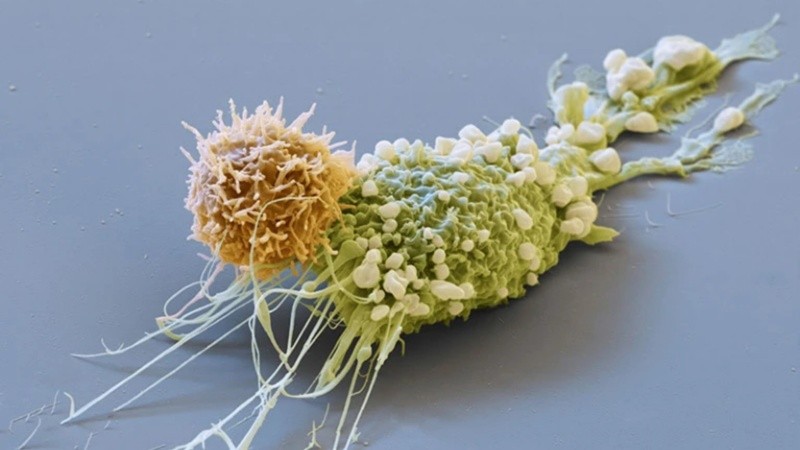
Las células inmunitarias llamadas células T se extraen de la persona que recibe el tratamiento, se modifican para atacar las células cancerosas y se reintroducen en su cuerpo. El proceso ha producido recuperaciones avanzadas de algunos cánceres de la sangre, pero su alto precio y su dificultad técnica lo han puesto fuera del alcance de muchas personas.
Los resultados presentados en la reunión anual de la Sociedad Estadounidense de Hematología en San Diego, California, el 11 de diciembre, sugierieron que las personas que reciben tratamiento podrían eventualmente recibir simplemente una inyección de un virus que infecta las células T. Luego, el virus insertaría los genes necesarios para guiar las células T hasta las células tumorales.
"No es necesario extraer las células, no es necesario purificarlas", pronunció John DiPersio, inmunólogo y oncólogo de trasplantes de la Universidad de Washington en St. Louis, Missouri.
Orientación de precisión
La clave, según determinaron los expertos, radica en encontrar formas de diseñar genéticamente células T para que expresen receptores de antígenos quiméricos (CAR), proteínas que reconocen el cáncer, sin interferir con los genomas de otras células. Para ello, se han estado modificando virus para que reconozcan moléculas que se encuentran sólo en la superficie de las células T.
En la conferencia de hematología, dos empresas presentaron los resultados de sus esfuerzos por utilizar virus para diseñar células T que aún se encuentran dentro de los cuerpos de los monos. Los equipos de Interius BioTherapeutics en Filadelfia, Pensilvania, y Umoja Biopharma en Seattle, Washington, generaron tratamientos CAR-T que se dirigen a otras células inmunitarias llamadas células B, imitando la acción de las terapias CAR-T aprobadas que tratan los cánceres causados por células B anormales.
En los experimentos de ambas empresas, el tratamiento fue suficiente para agotar las células B de los monos. Interius informó que los recuentos de células B se redujeron al menos en un 75% en 15 de los 16 animales tratados. Las dos compañías planean solicitar el próximo año autorización a la Administración de Alimentos y Medicamentos de EE.UU. para iniciar ensayos en personas.
"El objetivo ahora realmente está al alcance de la mano", dijo Stephen Russell, director ejecutivo de Vyriad, una empresa de biotecnología en Rochester, Minnesota, que presentó resultados similares en ratones en la reunión.
Células preparadas
Para DiPersio, los resultados de los monos fueron una sorpresa especial. Las células T tienden a estar en un estado inactivo mientras circulan en el torrente sanguíneo, lo que las hace menos propensas a ser infectadas por los virus utilizados para transportar los genes.
La esperanza es que la técnica pueda ampliar el uso de las terapias CAR-T: el coste actual del tratamiento y la atención hospitalaria necesaria pueden superar en conjunto el medio millón de dólares estadounidenses.
Sin embargo, ese enfoque también aguarda una serie de desafíos. Por un lado, los reguladores querrán ver pruebas de que el proceso realmente se dirige sólo a las células T y deja intactas las demás células.
Los investigadores también han intentado generar células CAR T a partir de células que han sido donadas por una persona no relacionada y diseñadas para evadir la detección por parte del sistema inmunológico del receptor. Si tiene éxito, permitiría utilizar células de un único donante para tratar a muchas personas. Ese enfoque todavía es prometedor, pero los resultados de estas terapias hasta ahora han sido decepcionantes, lo que ha generado un mayor interés en enfoques que pueden generar células CAR-T directamente en el cuerpo.
Fuente: Nature.